本文转自“梅斯医学”公众号
时钟基因是一组调控人体24 小时昼夜节律的核心基因,而CLOCK基因作为其中的“明星成员”,不仅编码着调节睡眠-觉醒周期的关键蛋白,更在人类大脑新皮层中展现出独特的 “超纲” 能力。新皮层作为支撑推理、决策、语言等高级认知的核心区域,长期以来让科学家困惑:CLOCK基因在这些功能中究竟扮演着怎样的角色?
近期,Nature Neuroscience发表了一项来自德克萨斯大学西南医学中心的突破性研究。研究团队通过人源化小鼠模型,首次证实CLOCK基因在人类进化中获得了全新功能——它能通过调控神经元连接,显著增强认知灵活性,为人类大脑的独特认知能力提供了分子层面的解释。

CLOCK基因的 “跨界” 能力
作为核心昼夜节律基因,CLOCK在人类新皮层中却呈现三大“反常” 特征:高表达且无节律性,调控大量非节律基因,且这种表达模式仅在人类中存在。论文共同通讯作者Genevieve Konopka 指出:“人类与非人灵长类的基因组对比反复显示,CLOCK在人类新皮层中特异性上调,这暗示它可能是人类高级认知进化的关键推手。”
为验证这一猜想,研究团队构建了特殊的人源化小鼠(HU):通过重组工程技术,将人类CLOCK基因及其侧翼调控区域导入Clock基因敲除小鼠体内,使其大脑中Clock的表达模式与人类新皮层高度一致——例如,HU 小鼠中 89% 的兴奋性神经元表达CLOCK,与人类大脑的86% 接近,而野生型小鼠仅为 62%。这一模型成为解锁CLOCK基因新功能的“金钥匙”。
实验数据说话
研究团队通过多层级实验,层层揭开CLOCK 基因的 “认知增强” 机制:
认知测试:HU 小鼠展现 “超能力”
在经典的定势转换任务(评估规则学习与灵活决策能力)中,HU 小鼠完成反转学习的试验次数比野生型小鼠显著减少(效应量 Cohen’s d=1.11),且这一结果在另一独立人源化小鼠品系中完全复刻(d=0.87)。更关键的是,仅过表达小鼠自身CLOCK基因的对照组(MS 小鼠)则与野生型表现无异,证明这是人类CLOCK基因特有的功能。
细胞层面:神经元连接“升级”
单细胞测序显示,HU 小鼠的兴奋性神经元中,与树突生长、突触形成相关的基因(如Tenm2、Sorcs2)显著上调。显微镜下可见,这些神经元的树突分支数量增加30%,突触棘密度提升 25%,形成更复杂的神经网络。而当人类 iPSC 诱导的神经元敲除CLOCK后,树突复杂度和突触前 puncta 密度明显下降,反向验证了其核心作用。
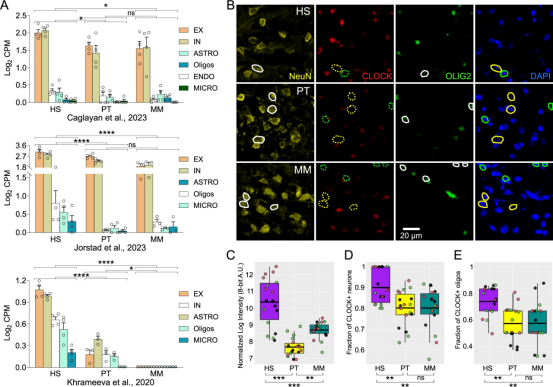
人类新皮层中CLOCK的特异性上调
电生理证据:信号传递效率飙升
记录HU 小鼠皮层神经元的兴奋性突触后电流(EPSC) 发现,其自发 EPSC 频率比野生型增加 40%,总信号传递效率(频率 × 振幅)显著提升,表明神经元间信息交流更频繁。这种增强并非源于神经元兴奋性改变,而是实打实的 “连接数量升级”。
CLOCK基因如何让人类 “脱颖而出”?
研究揭示,CLOCK基因的进化奥秘在于时空表达模式的革新:它跳出了昼夜节律的“生物钟框架”,通过调控人类特异性开放染色质区域的基因(如Tenm2促进轴突生长,Sorcs2维持突触形成),为大脑认知能力 “加码”。
更值得关注的是,这种功能拓展可能与人类认知疾病密切相关。此前研究发现,CLOCK基因异常与自闭症、精神分裂症等神经疾病高度相关,而本次研究提示,其调控的神经元连接异常可能是关键病理机制。
综上,这项研究打破了对时钟基因的传统认知——CLOCK不仅是昼夜节律的 “管理者”,更是人类大脑进化的 “关键设计师”。它通过重塑神经元连接网络,为人类认知灵活性提供了分子基础,也为理解认知疾病、开发靶向治疗开辟了新路径。未来,探索CLOCK基因在神经干细胞中的作用,或将进一步揭开人类大脑 “超凡进化” 的终极密码。
参考资料:
[1]Yuxiang Liu et al, Human CLOCK enhances neocortical function, Nature Neuroscience (2025). DOI: 10.1038/s41593-025-01993-4.


